METANO
El
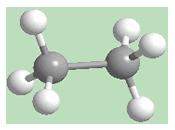
metano, el más simple de los hidrocarburos, es el resultado de la unión
de un átomo de carbono con cuatro hidrógenos. En éste, como en el
diamante, las cuatro valencias van dirigidas hacia los vértices de un
tetraedro (Figura 6).
El metano es un gas
volátil e inflamable que, por su alto contenido de calor, 13.14 Kcal/g,
es un combustible eficaz. Es el principal componente del gas natural, en
donde se encuentra junto con otros hidrocarburos gaseosos como etano,
propano y butano. Este gas, también llamado gas de los pantanos, por
formarse debido a la acción de microorganismos sobre la materia
orgánica, también se produce en el estómago de los mamíferos cuando
éstos tienen una mala digestión.
2.2 Estructura del metano
Cada
uno de los cuatro átomos de hidrógeno está unido al de carbono por un
enlace covalente, es decir, compartiendo un par de electrones. Cuando el
carbono está unido a otros cuatro átomos, sus orbitales enlazantes
(orbitales sp3, formados por mezcla de un orbital s y tres p) se dirigen
hacia los vértices de un tetraedro (Fig. 2.1a). Esta disposición
tetraédrica es lo que permite a los orbitales estar separados al máximo.
Para que cada uno de estos orbitales solape al orbital esférico s de un
átomo de hidrógeno con efectividad máxima, formando así un enlace más
fuerte, cada núcleo de hidrógeno debe ubicarse en un vértice de este
tetraedro (Fig. 2.1b).
La estructura
tetraédrica del metano ha sido verificada por difracción de electrones
(Figura 2.1c), lo que muestra fuera de toda duda la disposición de los
átomos en moléculas tan simples. Más adelante analizaremos algunas de
las pruebas que permitieron la mecánica cuántica o la difracción de
electrones.
Etano
| ||||||||||||||||
metanol
El metanol es un elemento químico básico utilizado en la fabricación de cientos de productos que afectan nuestras vidas diarias: desde pinturas, plásticos, muebles y alfombras, hasta piezas de automóviles y líquido limpiador de parabrisas. El metanol también es una fuente de energía emergente para el funcionamiento de coches, camiones, autobuses e incluso turbinas de energía eléctrica. El metanol, también conocido como alcohol metílico o alcohol de madera, es el más simple de todos los alcoholes. Su fórmula química es CH3OH.El metanol es un líquido incoloro, ligero, inflamable a temperatura ambiente que contiene menos carbono y más hidrógeno que cualquier otro combustible líquido. Es una sustancia química estable biodegradable que se produce y envía a diario a todo el mundo, y que tiene numerosas aplicaciones industriales y comerciales. El metanol se produce naturalmente en la naturaleza, y se descompone rápidamente, tanto en condiciones aeróbicas como anaeróbicas.
Etanol
| ||||||
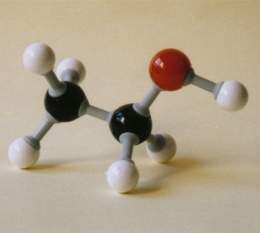
El alcohol etílico o etanol es un alcohol que se presenta como un líquido incoloro e inflamable con un punto de ebullición de 78 °C. Al mezclarse con agua en cualquier proporción, da una mezcla azeotrópica. Es un líquido transparente e incoloro, con sabor a quemado y un olor agradable característico. Es conocido sencillamente con el nombre de alcohol.
Su fórmula química es CH3-CH2-OH , principal producto de las bebidas alcohólicas.
El etanol es el alcohol que se encuentra en bebidas como la cerveza, la sidra, el [[Vino tinto|vino]] y el brandy. Debido a su bajo punto de congelación, ha sido empleado como fluido en termómetros para medir temperaturas inferiores al punto de congelación del mercurio, -40 °C, y como anticongelante en radiadores de automóviles.
Normalmente el etanol se concentra por destilación de disoluciones diluidas. El de uso comercial contiene un 95% en volumen de etanol y un 5% de agua. Ciertos agentes deshidratantes extraen el agua residual y producen etanol absoluto. El etanol tiene un punto de fusión de -114,1°C, un punto de ebullición de 78,5°C y una densidad relativa de 0,789 a 20°C.
PROPANO
El siguiente miembro de la familia de los alquenos es el propileno,
C3H6. Dada su gran similitud con el etileno, parece razonable suponer
que este compuesto también tiene un doble enlace carbono-carbono.
Partiendo de los dos átomos de carbono conectados con un enlace doble y
enlazando los demás átomos de acuerdo con la regla de una unión por
hidrógeno y cuatro por carbono, llegamos a la estructura
Siguiendo una vez más la regla de un enlace por hidrógeno y cuatro por carbono, llegamos a la estructura I.
Aquí,
la rotación puede producirse en torno a dos enlaces carbono-carbono, y
de nuevo es esencialmente libre. A pesar de que el grupo metilo es
considerablemente más grande que un hidrógeno, la barrera rotacional es
sólo ligeramente mayor (3.3 kcal/mol) que para el etano. Sin duda, la
aglomeración en la conformación eclipsada aún no es significativa, por
lo que la barrera rotacional se debe esencialmente al mismo factor que
la barrera del etano:
tensión torsional (véase Fig. 3.7).
Propanol
también llamado alcohol isopropílico, es un alcohol incoloro, inflamable, con un olor intenso y muy miscible con el agua. Es un isómero del propanol y el ejemplo más sencillo de alcohol secundario, donde el carbono del grupo alcohol está unido a otros dos carbonos.
Cuando este alcohol se oxida se convierte en acetona ya que los alcoholes secundarios se convierten en cetonas (a diferencia de los alcoholes primarios que se convierten en aldehídos).